近日,我校伟德BETVlCTOR1946、医药生物技术国家重点实验室李根喜教授与上海大学朱小立教授等合作在基于生物分子工程构建离子通道方面取得重要进展,相关研究成果以《Rhodopsin-Like Ionic Gate Fabricated with Graphene Oxide and Isomeric DNA Switch for Efficient Photocontrol of Ion Transport》为题,发表在J. Am. Chem. Soc. 2019, 141: 8239-8243.
生物离子通道是一种成孔膜蛋白,通过控制胞内外的离子运输在复杂的生命过程中发挥着重要作用。研究表明,几乎所有的细胞过程都依赖离子通道。因此,离子通道一直是生物医学研究的热点前沿领域。然而,天然的通道蛋白由于极不稳定,限制了其在体外环境中作为实验材料的应用。近年来,人工构建离子通道的研究引起了广泛关注,为生物离子通道传输机制的研究创造了条件,也为生物传感设计、智能仪器制造奠定了基础。
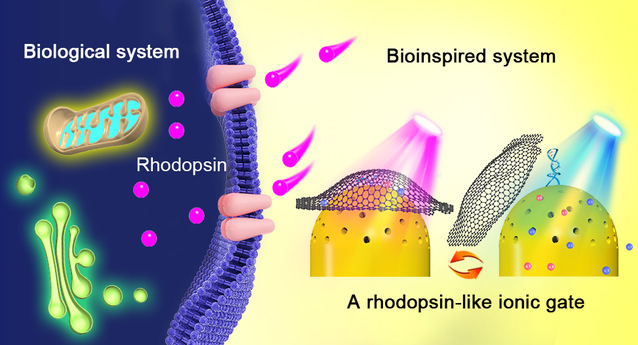
图1 基于氧化石墨烯与嵌入偶氮苯的DNA相互作用构建的离子门控示意图。
李根喜教授课题组长期从事生物分子工程及生物医学应用方面的研究工作,近期与上海大学的朱小立教授等合作,利用氧化石墨烯与光学异构化偶氮苯嵌入的DNA (Azo-DNA)相互作用,在阳极氧化铝薄膜电极表面构建了一种仿生视紫红质的离子门控。感光细胞中的视紫红质是由视蛋白通过Lys296与11-顺式-视黄醛共价相连组成的,光触发视紫红质的组分11-顺式-视黄醛转化为全反式视黄醛,结构的改变导致视蛋白与视黄醛分离。他们受该现象的启发,利用Azo-DNA的光学响应性,设计并构建了一种仿生视紫红质的离子门控(图1)。该研究首次基于氧化石墨烯与修饰在阳极氧化铝薄膜电极表面的Azo-DNA之间的相互作用,制备了生物模拟的光敏离子门控。如图2所示,光响应的偶氮苯分子在可见光(430 nm)下呈现平面反式状态,在紫外光(365 nm)照射下呈现非平面顺式状态,相应地,Azo-DNA在不同的光照下可形成单链或被稳定成双链结构,因此可作为光敏感受器。在交替光照射下形成的单、双链DNA由于与氧化石墨烯的结合能力不同,产生氧化石墨烯与阳极氧化铝薄膜表面结合和脱落两种情况,从而实现了离子门控在“关”和“开”之间的可逆切换。此外,该光控离子通道利用阳极氧化铝薄膜阻挡层微小的通道作为离子通道主体,获得了更高的开关控制效率。
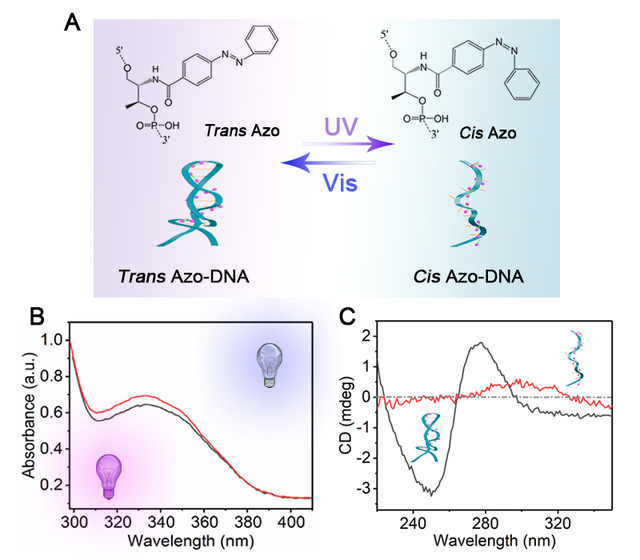
图2 偶氮苯与Azo-DNA光学异构化原理图
与通过在纳米通道中修饰特定物质而需要复杂的修饰过程和制备过程的人工离子通道不同,该设计具有操作简单、通用性强等优点。此外,由于氧化石墨烯的高阻隔性,而且阻挡层中通道的直径极小,因此他们构建的离子门控具有优异的开关效率和交替光照射下离子输运开关可逆能力。
我校硕士研究生石榴同学为文章的第一作者,李根喜教授和朱小立教授为共同通讯作者。研究工作得到了国家自然科学基金的支持。