本课题组前期从海洋对虾的肠道中分离得到一株海洋放线菌Streptomycesseoulensis A01,从该菌株的发酵液中分离到一个具有抗幽门螺旋杆菌活性的新颖大环内酯化合物streptoseomycin(STM, 1) [Org. Lett. 20, 2967–2971 (2018)]。前期在研究其生物合成过程中,发现了自然界首个可同时催化[6+4]/[4+2]环加成反应的周环酶StmD[Nature 568,122–126 (2019)]。 [6+4]和[4+2]产物可通过Cope重排相互转化,且[6+4]环加成产物在热力学上更稳定。那么,在streptoseomycin的后续生物合成中,究竟哪一种产物才能真正参与到STM的生物合成中呢?
为了破解上述谜题,近日,研究团队通过基因重组、体外酶生化反应及量子化学计算鉴定了StmD下游的三个氧化还原酶StmO1、StmO2、StmK利用[6+4]-产物作为底物,经一系列的酶促与非酶促级联反应高效构建10/6/6三环骨架,相关成果“A[6+4]-cycloaddition adduct is the biosynthetic intermediate in streptoseomycinbiosynthesis”2021年4月7日在线发表在《自然-通讯》杂志上。

研究者原本猜想,stm基因簇上是否存在烯酰还原酶直接还原[4+2]产物中α,β不饱和双键,随后氧化酶在C2位发生羟基化,生成化合物11(Fig. 1c, path a)。基于此,研究人员分析了这两条基因簇并定位到三组高度保守的氧化还原酶StmO1/NgnO1、StmO2/NgnO2和StmK/NgnK。遗憾的是,敲除stmO1、stmO2和stmK均未累积化合物(Fig. 2)。研究者转变思路,采用“bottom-up”策略将stmO1、stmO2和stmK逐个回补到只产生[6+4]和[4+2]产物的stmABCD菌株中,但同样也没有累积化合物。仔细分析stmO1-O2的编码区,研究者注意到基因部分重叠,暗示stmO1-O2可能位于同一操纵子上。于是研究者完整克隆stmO1-O2并导入stmABCD菌中,果然发酵图谱产生了三个新峰8,9,10(Fig. 2)。通过核磁鉴定了这三个化合物,有意思的是,8和9具有罕见的、异于终产物STM的6/6/6/6四环骨架。饲喂实验表明8-10都是支路产物,无法恢复STM的产生。进一步分析,研究者认为10是StmO1-O2直接氧化5得到的,而8则是StmO1-O2氧化6生成的化合物不稳定重排产生的。
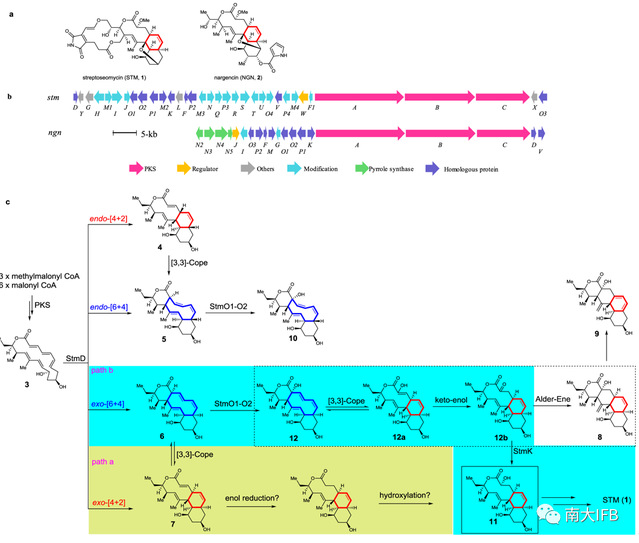
Fig. 1: Biosynthesis of streptoseomycin.
既然无法直接从stmABCDO1O2菌株中获取中间体,研究者猜想是否向其再导入下游基因就能捕获中间体,得到稳定的化合物。于是他们导入了NAD(P)H依赖的还原酶stmK,果然检测到额外的新峰11(Fig. 2)。通过核磁数据研究人员确证11具有与终产物一致的10/6/6三环骨架,饲喂实验也表明11能够恢复1的产生。以上数据表明只需stmABCDO1O2K七个基因就足够产生中间体11。
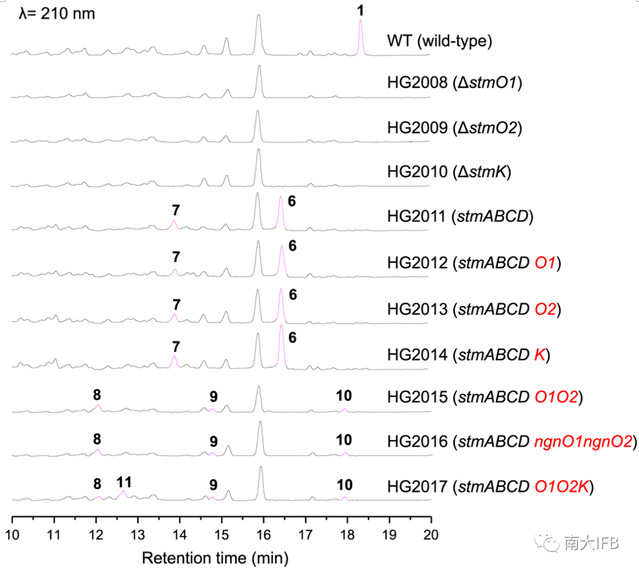
Fig. 2: HPLC analysis of wild-type and recombinantstrains.
为了进一步验证StmO1-O2、StmK的催化功能,研究人员对它们催化的反应进行了体外重构(Fig. 3)。首先,他们获得了StmO1-O2的同源蛋白NgnO1-O2,当加入6/7和辅因子时,观察到了化合物8、12和12b的产生。为了鉴定究竟是[6+4]还是[4+2]环加成产物才是其反应底物,研究人员巧妙利用6的结构类似物5作为底物,发现能够生成10,充分说明[6+4]产物才是NgnO1-O2的反应底物。最后研究人员将StmK直接加入NgnO1-O2的反应体系中,“一锅”反应生成11。同时他们还重构了StmK的逆反应,当加入11和辅因子时观察到8和痕量12b的产生,进一步佐证了StmK的功能。
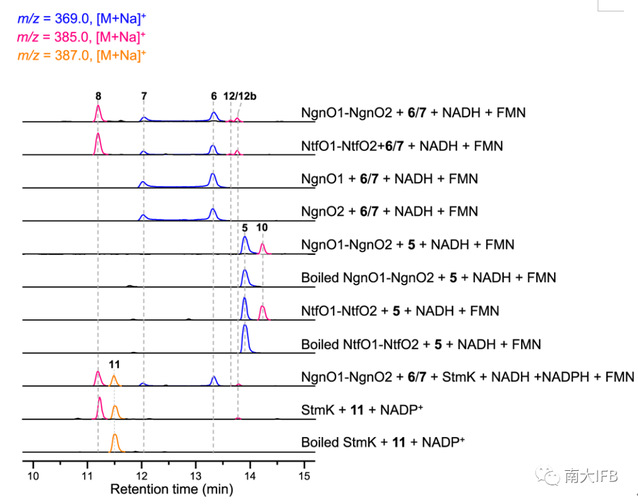
Fig. 3: LC-MSanalysis of NgnO1-NgnO2, StmK, and NtfO1–NtfO2 catalyzed reaction.
基于以上结果,研究者对6到11的生物合成过程进行了推测:StmO1-O2直接氧化6中sp3杂化的C2原子,生成化合物12,经Cope重排迅速生成12a,再经烯酮异构变成12b(Fig. 1c,path b)。此时,若StmK存在,12b会被还原产生中间体11。而当StmK不存在时,12b会经Alder-ene反应自发生成支路产物8。
为了更好地理解上述Cope重排、烯酮异构和Alder-ene反应之间的关系,研究人员通过密度泛函理论计算了反应物、过渡态及产物的自由能(Fig. 4)。相比化合物10,化合物12发生Cope重排所需能垒更低,易于发生。进一步计算表明,尽管发生Alder-ene反应的能垒比Cope重排高,但由于生成8是放能过程,所以该反应室温下也容易发生。理论计算结果与实验观察结果相吻合。
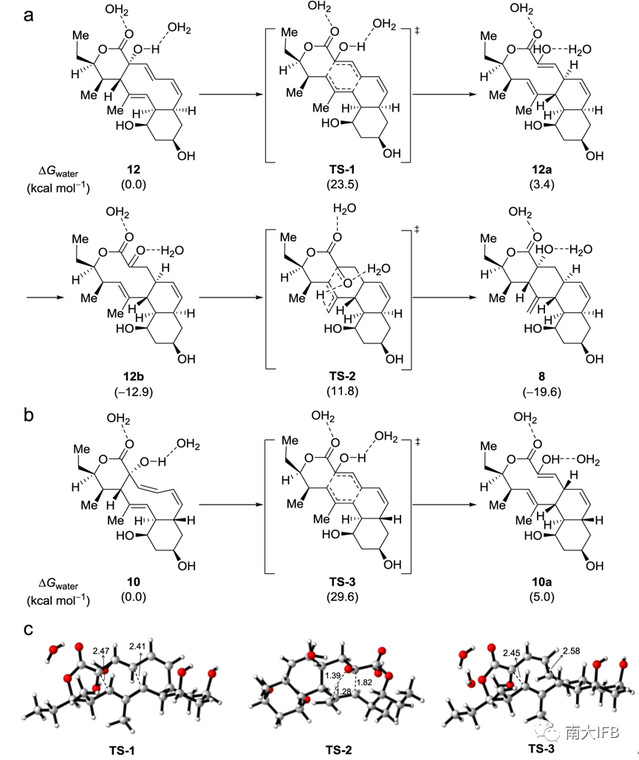
Fig. 4:DFT-computed Gibbs free energies.
最后,研究人员获得了StmO1-O2同源蛋白NtfO1-O2的蛋白晶体,有趣的是,它是一个异源二聚体结构,这与前面StmO1-O2必须同时存在才能发挥作用相一致(Fig. 5)。通过分子对接和点突变实验,研究者初步确定了酶的活性中心,相关的催化机制正在研究。
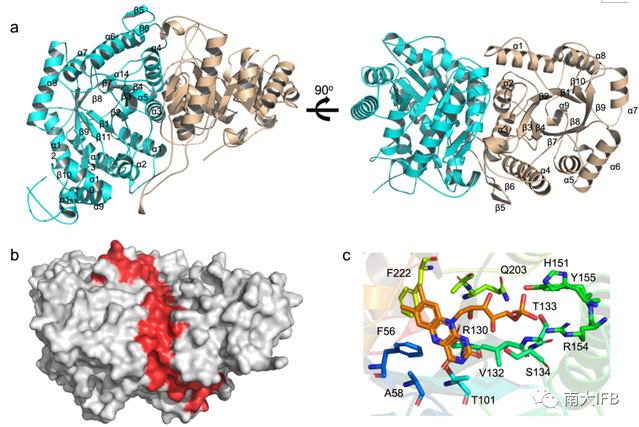
Fig. 5:Crystal structure of NtfO1–NtfO2.
综上所述,研究者通过体内基因重组、体外生化反应、量子化学计算以及蛋白晶体学研究等,确证了[6+4]产物才是streptoseomycin生物合成过程真正的中间体。这一工作承上启下完善了streptoseomycin的生物合成步骤,揭示了[6+4]环加成产物所扮演的重要角色,阐明自然界利用酶促与非酶促反应相配合的策略精准地合成天然产物。
BETVLCTOR伟德官网下载王凯标博士、王文博士研究生和张博副教授为该论文共同第一作者,戈惠明、谭仁祥和梁勇教授为共同通讯作者。该研究得到了国家重点研发计划,国家自然科学基金杰青项目、重大项目,中央高校基本科研业务费和江苏省双创计划等项目的资助。特别感谢BETVLCTOR伟德官网下载医药生物技术及配位化学国家重点实验室,以及BETVLCTOR伟德官网下载高性能计算中心提供的服务。