近日,伟德BETVlCTOR1946朱海亮教授团队与合作者们在转铁蛋白纳米材料对中枢神经肿瘤治疗方面取得新的进展。
肿瘤微环境(TME)具有与正常生理条件不同的物理化学特征,如缺氧、低 pH、高GSH和高血管通透性。其中缺氧环境与肿瘤生长、转移与预后密切相关。肿瘤内部血管不受控制的增殖和异常发育决定了肿瘤高代谢的特点。肿瘤细胞的高代谢特性造成肿瘤细胞内部缺氧微环境,缺氧微环境对肿瘤细胞具有筛选作用,进一步提高肿瘤的恶性程度,导致肿瘤细胞对化疗药物或放射治疗不敏感。伟德BETVlCTOR1946朱海亮教授团队在先前聚焦解决TME缺氧问题的纳米载药平台开发基础上(ACS Appl. Mater. Interfaces 2020, 12, 22, 24662–24674)根据转铁蛋白及其受体的同源识别能力,首次构建原位脑胶质瘤靶向转铁蛋白介导的内源刺激响应性多功能纳米载药平台(图1)。该平台解决药物穿过血脑屏障、靶向缓控释药、影像示踪及肿瘤缺氧难题,显著性抑制了包括中枢神经系统(CNS)肿瘤在内的多种恶性肿瘤的生长,缓解了实体瘤微环境中难治性的缺氧问题,实现了光动力治疗联合化疗效果的协同性增强,为恶性肿瘤的治疗提供了一种新策略。
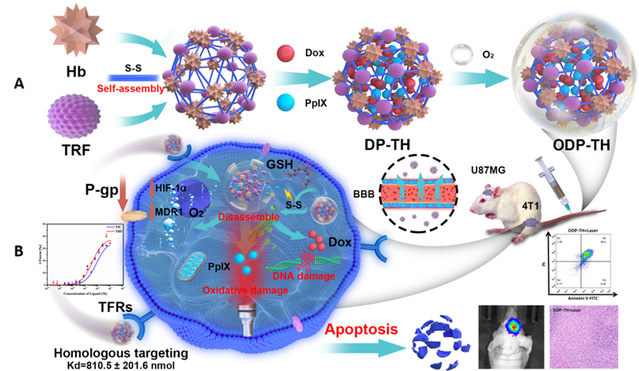
图1.ODP-TH多功能药物纳米递送平台的3D体外构建示意图(A)和体内模块化作用机制(B)
将转铁蛋白和血红蛋白通过二硫键重构的自组装方式包载化疗药物Dox和光敏剂PpIX,体外整合氧气构建出既具有携氧能力又具有原位脑胶质瘤精准靶向性功能的杂合蛋白纳米载药平台ODP-TH。一方面,该转铁蛋白药物载体能特异性识别并结合肿瘤及脑内皮细胞细胞表面过表达的转铁蛋白受体,经转铁蛋白受体介导跨过血脑屏障,选择性地富集到中枢神经肿瘤细胞处,在低氧高GSH浓度的肿瘤微环境中将包封的药物和运载的氧气快速、持续释放。另一方面研究供氧型转铁蛋白介导的多功能纳米载药系统对了解肿瘤微环境缺氧的而导致的疾病机制,建立成体系的生物安全性好、靶向性强、响应迅速及协同抗肿瘤的供氧型药物纳米递送平台方法,解决由于缺氧引起的多种氧气相关基因表达紊乱(MDR1、HIF-1α和P-gp),减少化疗药物外排,缓解化疗中常见的耐药不良现象有着深远现实的应用价值。
较小的纳米材料粒径(30.2±1.2 nm)最大程度地助力了ODP-TH表面携氧,使其能在低pO2的环境中30 min内完成氧合构象至脱氧构象的自由转换。牢固的二硫键铆钉,使ODP-TH在非TME中维持形态及功能的稳定。一旦进入还原型GSH富集的TME后,其优异的GSH响应机制能确保纳米材料迅速发生崩解,确保整个平台的协同治疗功能在特定癌灶区域内快速发挥作用(图2)。
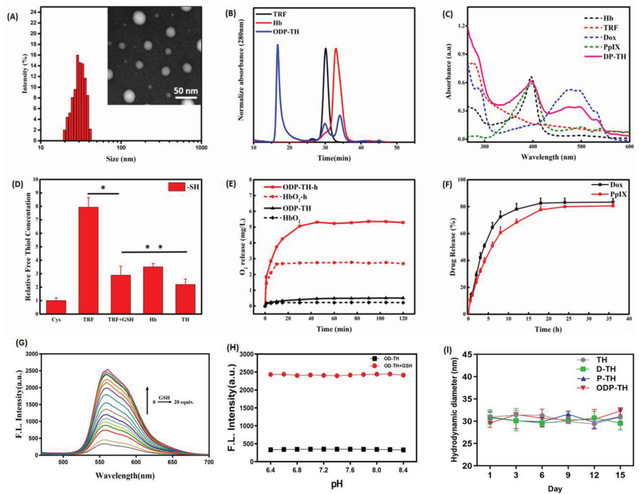
2.ODP-TH药物纳米递送平台的理化性质。(A)ODP-TH的粒径分布及透射电镜照片。(B)TH纳米外壳的排阻色谱(SEC)图。(C)Hb、TRF、Dox、PpIX和DP-TH的紫外吸收光谱图(UV–vis)。(D)不同组别间游离巯基浓度的比较统计图。(E)不同组别间氧气释放曲线统计图。(F)ODP-TH在 GSH(5 mm)作用下不同时间的药物释放曲线。(G)Dox的释放和GSH浓度的依赖关系。(H)pH值的变化对药物释放的影响。(I)TH、D-TH、P-TH 和ODP-TH 其水合粒径与时间依赖图。
团队还构建了原位脑胶质瘤动物模型,利用液质联用、肿瘤免疫、蛋白纯化、细胞迁移检测、多模态成像等技术统地评估了该纳米平台跨血脑屏障靶向脑胶质瘤的功能及其药物学特性。该平台通过基于氧气靶向运输实现多维度光动力治疗联合化疗效果的协同性增强(图3),不仅为未来彻底治愈脑胶质瘤提供新的方法,还为生命科学、医学、化学与材料学等学科的相互交叉融合发展提供新的思路。
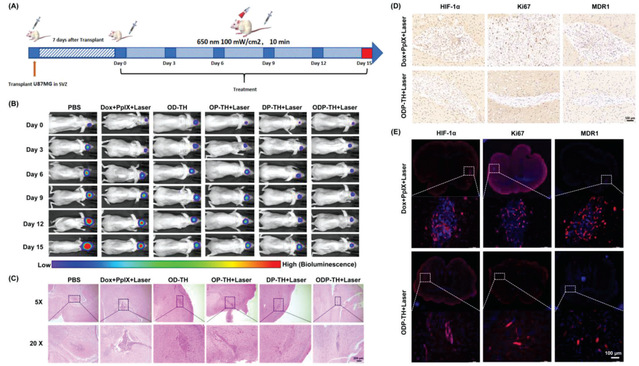
3.原位脑胶质瘤疗效。(A)原位脑胶质瘤治疗过程示意图。(B)在治疗过程中对脑胶质瘤发展的实时监测。(C)终点后不同治疗组别小鼠脑切片HE染色图片。(D,E)不同治疗组别小鼠脑切片免疫组化及免疫荧光图片。
该工作以Multifunctional Protein Hybrid Nanoplatform for Synergetic Photodynamic Chemotherapy of Malignant Carcinoma by Homologous Targeting Combined with Oxygen Transport为题发表在Advanced Science2022,2203742上。BETVLCTOR伟德官网下载生科院18级博士研究生武松宇为本文的第一作者,BETVLCTOR伟德官网下载生科院朱海亮教授、王忠长副研究员,南京医科大学邹美娟副教授和郑州大学附属儿童医院段勇涛副研究员为本文的通讯作者,BETVLCTOR伟德官网下载为第一作者和通讯单位。BETVLCTOR伟德官网下载生科院19级硕士许朱民、康倩瑾对本研究工作做出重要贡献。特别感谢BETVLCTOR伟德官网下载江亚军研究员对该工作的支持和帮助!该研究工作得到了国家自然科学基金、中国博士后科学基金等项目的资助。论文在线链接为:https://doi.org/10.1002/advs.202203742。