新型冠状病毒(SARS-CoV-2)是一类重要的病原体,由它引发的COVID-19大流行是一场前所未有的全球性健康危机,已导致全球超过686万人死亡。迄今为止,对冠状病毒的基础研究、药物设计和疫苗研发仍有很多重要的科学问题没有解决。自2021年11月起,奥密克戎(Omicron)变异毒株及其亚型逐渐成为主要流行毒株。Omicron变异毒株的刺突蛋白(Spike)不断积累新的突变位点,使病毒具有更强的传染性和免疫逃逸能力。因此,迫切需要开发针对所有SARS-CoV-2流行毒株的新型广谱中和抗体,并深入研究广谱抗体的中和机制。
近日,伟德BETVlCTOR1946医药生物技术国家重点实验室籍晓云课题组联合BETVLCTOR伟德官网下载医学院附属鼓楼医院陈雨欣团队,利用冷冻电镜单颗粒技术解析了Omicron变异毒株BA.1亚系的Spike蛋白与一种兔源单克隆抗体(RmAb)1H1复合物的高分辨率结构。研究团队从结构生物学角度阐明1H1独特的广谱中和机制,为深入理解病毒与抗体相互作用的结构基础和开发更多具有广谱中和活性的治疗性抗体提供新的思路。

研究团队首先利用假病毒细胞感染实验,确定了1H1(从接受DNA初次免疫-蛋白质增强免疫策略的免疫家兔中分离)能够有效中和多种新冠假病毒,包括野生型(WT)、Delta和最近流行的Omicron亚系BA.1、BA.1.1、BA.2、BA.2.12.1、BA.2.75、BA.3以及BA.4/5毒株。这表明1H1具有巨大的潜在广谱中和活性。ELISA实验和BLI实验也从生化水平证明1H1对这些毒株Spike蛋白的ECD和RBD均表现出很强的结合亲和力。
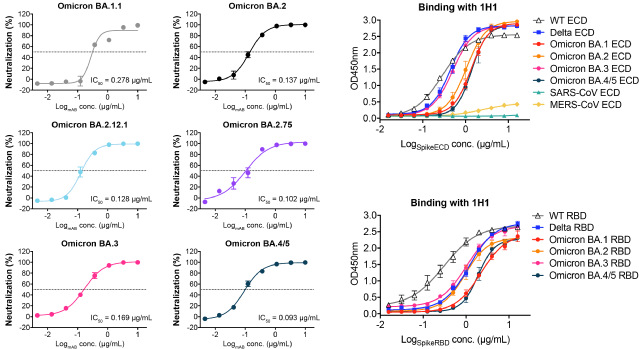
图1. 兔源中和抗体1H1广谱中和SARS-CoV-2 Omicron亚系
研究团队使用冷冻电镜技术获得了BA.1 Spike-1H1 Fab复合物的两种结合模式的高分辨率结构模型,分辨率分别为3.41 Å与3.70 Å。在这两类复合物中,每个Spike蛋白均同时与3个1H1 Fab结合。在第I类复合物中,BA.1 Spike蛋白存在一种三个“半开放”构象RBD的状态,呈现出3级对称形式;在第II类复合物中,BA.1 Spike蛋白只有一个RBD处于“半开放”构象,另两个RBD均处于“开放”构象。在这两类复合物中,1H1结合RBD的表位与ACE2结合位点均不重叠,表明1H1不直接与ACE2竞争结合RBD。进一步的结构分析表明,1H1通过自身的空间位阻或诱导RBD稳定在“半开放”构象,从而阻断Spike蛋白与受体ACE2结合,进而发挥中和作用。
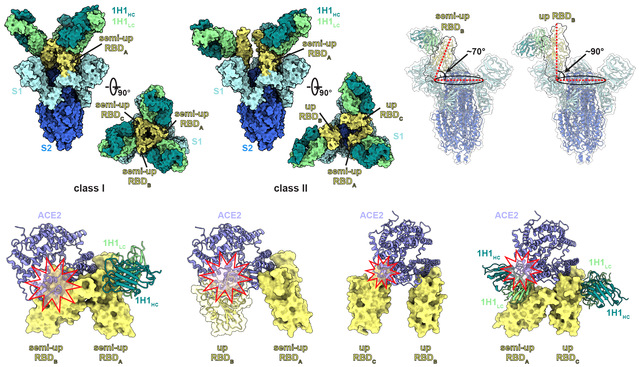
图2. 冷冻电镜结构揭示1H1避开Omicron突变位点的独特结合模式
为了进一步揭示1H1对Omicron具有广谱中和活性的结构基础,研究团队使用局部分辨率优化技术将BA.1 RBD-1H1 Fab相互作用界面的分辨率提升至3.52 Å。研究人员发现,BA.1 RBD包含的15个突变位点都没有分布在1H1的表位上。此外,除了在BA.1.1中发现的R346K突变位点外,其他Omicron亚系(包括BA.2、BA.3和BA.4/BA.5)中额外增加的突变位点也都避开了1H1的表位,表明Omicron变异不会直接影响1H1与RBD之间的相互作用。因此,研究团队证明1H1具有强大的结合能力和不受Omicron突变影响的独特表位区域,使其成为一种潜在的高效和广谱单克隆抗体,可用于对抗不同的新型冠状病毒变异毒株。
综上所述,本研究鉴定了一种对BA.1, BA.1.1, BA.2, BA.2.12.1, BA.2.75, BA.3和BA.4/5具有广谱中和效力的兔源单克隆抗体1H1,可以对抗不同的新型冠状病毒变异毒株,包括Delta和Omicron,并阐明1H1广谱中和活性的分子机制,为广谱抗体设计和疫苗研发提供新的思路。该研究成果以“Mechanism of a rabbit monoclonal antibody broadly neutralizing SARS-CoV-2 variants”为题,于2023年4月3日发表在国际期刊《通讯-生物》(Communications Biology)上。伟德BETVlCTOR1946博士后郭航天、伟德BETVlCTOR1946硕士研究生杨绎煊、南京鼓楼医院硕士研究生赵甜甜和上海科技大学免疫化学研究所博士研究生卢宇驰为该论文的共同第一作者,伟德BETVlCTOR1946籍晓云教授和BETVLCTOR伟德官网下载医学院附属鼓楼医院陈雨欣为该论文的共同通讯作者。该研究工作也得到了国家重点研发计划和国家自然科学基金等项目的资助,在此一并致谢!
关键词:新型冠状病毒;奥密克戎;兔源单克隆抗体;冷冻电镜;广谱中和抗体。
原文链接:https://www.nature.com/articles/s42003-023-04759-5