细胞膜上的钾离子通道具有内向整流效应,即钾离子经过通道向细胞内输送的效率高于向外的效率,这一效应被认为来源于细胞内阳离子(例如镁离子Mg2+)和多胺的阻挡。受这种生命现象的启发,我校李根喜教授课题组近期与沙特阿拉伯纳吉兰大学Farid A. Harraz教授、南京师范大学高涛副教授合作,通过在人工纳米通道内修饰多肽分子,仿生构建了一种用于疾病标志物检测的生物传感平台,并且利用多肽等电点的变化实现了离子电流整流效应的可靠调控,从而实现了特定种类酶的检测。
不同种类的多肽具有特征的等电点,其电学性质依赖于生物体系的酸碱(pH)环境,从而体现出不同的生物功能。同时,由于多肽具有易修饰、组装多样化和生物友好性等特点,因此可以通过热力学和动力学因素来调控多肽的组装,并将其嵌入在纳米空间内来实现多种生物功能。如图1所示,研究团队将功能性多肽修饰在人工纳米通道中,在生理pH条件下,不同等电点的多肽序列使得通道表面带有正负性相反的电荷。带正电荷的纳米通道具有阴离子选择性,表现出阴离子通道的整流效应。相反,当修饰带负电荷的多肽时,纳米通道表现出离子整流方向的反转现象,并且可以反映在电流-电压(I-V)测量曲线上。由于在特定酶的作用下,多肽的等电点将发生改变,因此,如果在纳米通道中修饰含有特定酶作用位点的多肽,则可以通过纳米通道电学特性的变化实现特定酶的检测。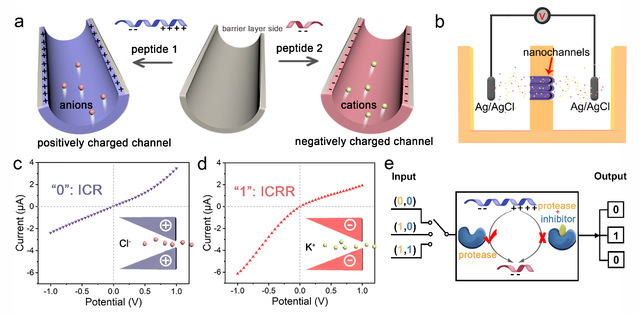
图1 利用多肽功能化纳米通道的离子电流整流反转构建电化学生物传感的原理
李根喜教授课题组长期从事生物分子工程及疾病诊断应用方面的研究工作,因此研究团队以肿瘤标志物基质金属蛋白酶-2(MMP-2)的检测为例,将含有MMP-2酶切位点的多肽作为底物肽修饰在纳米通道的表面(图2),底物肽的等电点大于生理pH,该底物肽功能化修饰的纳米通道表面带正电荷,但是在MMP-2的催化下,底物肽在肽序列PLGVR的Gly和Val之间被切割,导致呈正电荷的氨基酸脱落,留在通道表面的多肽的等电点随之改变。因此,在生理条件下,多肽酶切将纳米通道表面电荷极性从正电调控为负电,并且相应地可以直观地反映在I-V曲线上。
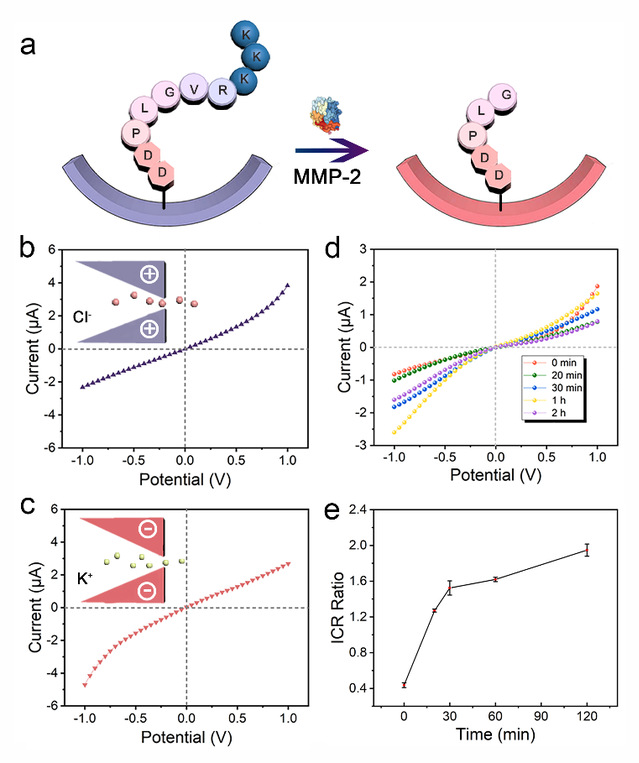
图2 多肽功能化纳米通道用于肿瘤标志物的检测
进一步研究表明,该传感平台不仅能够用于蛋白酶的可靠检测,而且可以拓展应用到酶抑制剂的筛选。同时,该平台基于多肽等电点变化产生的离子整流反转作为生物传感器的输出信号,因此更加准确、直观。此外,由于多肽具有丰富的物化性质和生物功能,利用多肽组装可以设计更多新颖的生物传感界面,从而应用到更广泛的与多肽相关的疾病标志物的分析检测。
上述成果以“Peptide Assembled in Nano-Confined Space as Molecular Rectifier for the Availability of Ionic Current Modulation”为题发表于Nano Letters(DOI:https://doi.org/10.1021/acs.nanolett.1c04154),李根喜教授与南京师范大学高涛副教授、沙特阿拉伯纳吉兰大学Farid A. Harraz教授为共同通讯作者,BETVLCTOR伟德官网下载博士研究生石榴为论文第一作者。该项工作得到了国家自然科学基金、中央高校基本科研基金、江苏省自然科学基金以及国际合作项目沙特阿拉伯教育部研究与创新基金等基金的资助。