我校伟德BETVlCTOR1946、医药生物技术国家重点实验室和脑科学研究院朱景宁教授、王建军教授团队对组胺和中枢组胺能神经系统(central histaminergic nervous system)在帕金森病(Parkinson’s disease)和深部脑刺激(deep brain stimulation)改善帕金森病运动障碍的作用和机制研究中取得重要进展,研究成果以“Regularizing firing patterns of rat subthalamic neurons ameliorates parkinsonian motor deficits”为题于2018年10月29日在经典的医学领域一流期刊、NI指数刊物The Journal of Clinical Investigation (JCI )上正式在线发表(https://www.jci.org/articles/view/99986) ,并将 于 2018年 12 月期刊载。同期JCI还将为该工作专门配发特约评论“Histamine and deep brain stimulation: the pharmacology of regularizing a brain”(https://www.jci.org/articles/view/124777),其出版的当月文摘JCI This Month 将为这一工作做出重点推荐。
帕金森病是一种常见和严重的神经退行性疾病,由支配基底神经节环路的多巴胺能神经元退变所致。其临床症状主要表现为运动障碍,包括运动发起困难、肌肉僵直和静止性震颤等。底丘脑核(subthalamic nucleus)是基底神经节环路中唯一的兴奋性谷氨酸能核团,不仅是经典间接通路(indirect pathway)中的关键节点,而且与大脑皮层之间构成超直接通路(hyperdirect pathway),甚至被认为是驱动整个基底神经节活动的起搏器(pacemaker)。底丘脑核由于其在基底神经节环路功能中的重要地位而成为临床神经外科深部脑刺激治疗帕金森病的首选靶区之一。尽管深部脑刺激底丘脑核可显著改善帕金森病运动障碍,其有效性已得到广泛认同,但其发挥效应的神经机制至今不明。
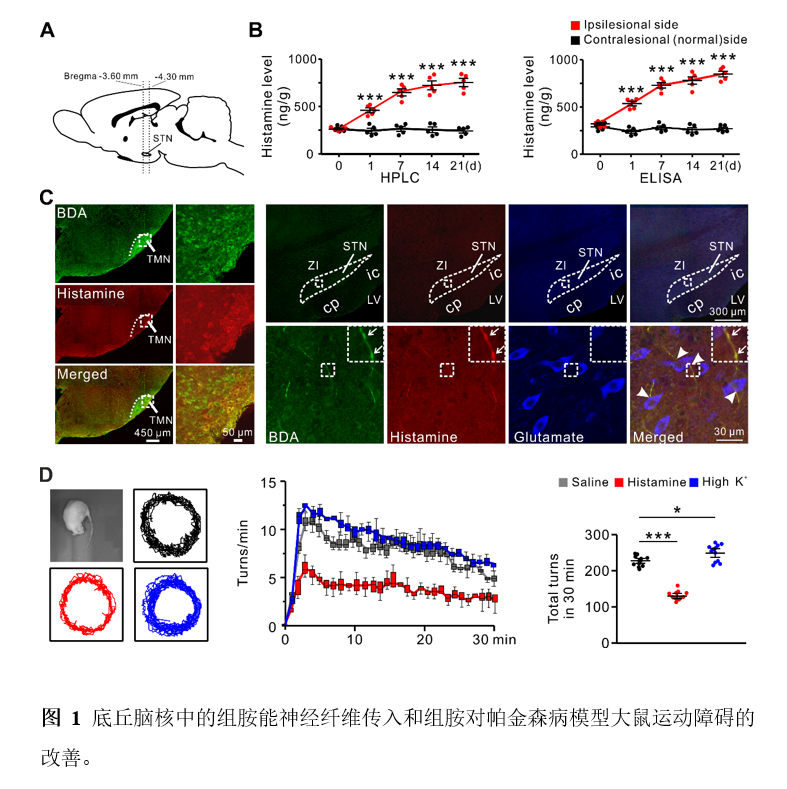
朱景宁、王建军课题组的该项研究揭示了底丘脑核神经元的放电模式(firing pattern)比放电频率(firing rate)对运动控制更加重要。已经知道,帕金森病患者和各类帕金森病模型动物均表现出底丘脑核神经元放电频率的升高和放电模式的紊乱。该课题组的工作揭示,底丘脑核接受源自下丘脑结节乳头体核的中枢组胺能神经系统的直接神经投射,且帕金森病模型大鼠底丘脑核中的组胺水平随多巴胺水平的下降而逐步升高(图1)。值得注意的是,组胺不仅兴奋底丘脑核神经元(即增加其放电频率),更重要的是可以使其放电模式规则化。因此,与高钾兴奋底丘脑核神经元加剧帕金森病运动障碍相反,组胺却显著改善帕金森病运动障碍(图1),从而提示组胺的改善效应是由其规则化了底丘脑核神经元的放电模式而非增加放电频率所致。并且,该课题组的进一步工作揭示了这一效应由突触后组胺H2受体及其耦联的HCN2通道所介导。
在此基础之上,该课题组发现深部脑刺激底丘脑核在改善帕金森病模型大鼠运动障碍的同时,不仅显著增加底丘脑核中组胺的释放,而且规则化底丘脑核神经元紊乱的放电模式;而下调底丘脑核中HCN2通道的表达则显著削弱深部脑刺激底丘脑核对运动障碍的改善效应,并减弱深部脑刺激对底丘脑核神经元紊乱放电模式的规则化和对β振荡的改善(图2)。这一研究揭示了内源性组胺和中枢组胺能神经系统对于底丘脑核神经元放电模式的规则化和基底神经节环路正常运动功能的维持是不可或缺的,帕金森病患者脑中组胺水平的升高,很可能是中枢组胺能神经系统对神经元活动紊乱了的基底神经节环路的一种功能性代偿。
该研究成果不仅有助于深入理解基底神经节环路和帕金森病发生和发展的神经机制,而且将为临床发展治疗帕金森病的新药物、新靶点和深部脑刺激新策略提供新的视角。
伟德BETVlCTOR1946庄乾兴副研究员、李光英博士研究生和李斌副研究员为该论文的共同第一作者,张长征博士、张潇洋助理研究员、奚康硕士研究生和李红召高级工程师参与了该项研究。该工作受到国家自然科学基金、国家自然科学基金与香港研究资助局联合科研基金项目、教育部博士点基金与香港研究资助局研究用途补助金合作项目、新世纪优秀人才支持项目、中央高校基本科研业务费和江苏省自然科学基金的资助。