现代社会,紧张而充满压力的工作生活往往引发强迫症(obsessive-compulsive disorder)和焦虑症(anxiety disorders)。60岁以下成年人中焦虑症的终生患病率约为30-35%,而一般人群中完全强迫症的终生患病率约为2-3%、强迫症状的终生患病率则高达25%以上。二者均被WHO列为全球非致命健康损失的主要贡献者。强迫症以反复闯入的、不可控的强迫思维(obsessions)和仪式化的、重复的强迫行为(compulsions)为主要症状,而强迫行为的发生往往是为了摒弃强迫思维和缓解由强迫思维引起的焦虑,提示强迫症与焦虑症密切相关。事实上,流行病学调查表明,焦虑症是强迫症最常见的共病。然而,二者共病的神经环路基础和临床有效治疗靶点至今不明。
近日,我校伟德BETVlCTOR1946、医药生物技术国家重点实验室和脑科学研究院朱景宁教授团队在强迫症和焦虑症共病的神经机制和潜在改善靶点的研究中取得重要进展。该课题组在其近年来对下丘脑调控基底神经节环路功能系列研究(Zhuang et al., J Clin Invest, 2018; Ji et al., Mol Psychiatry, 2019)的基础上,新构建了HDC-Cre大鼠(HDC为体内催化组胺合成的关键酶),并发现选择性激活中枢组胺能神经系统的唯一起源下丘脑结节乳头体核(tuberomammillary nucleus, TMN)到伏隔核(nucleus accumbens, NAc)核心部的组胺能直接神经投射能够通过作用于突触前H3受体,改善由急性束缚应激诱导的焦虑和强迫症样行为(图1)。NAc核心部中的组胺H3受体作为突触前异身受体发挥选择性抑制谷氨酸能而非GABA能突触传递的作用。尽管组胺H3受体在来自内侧前额叶皮层的前边缘皮层(prelimbic prefrontal cortex, PrL)、基底外侧杏仁核(basolateral amygdala, BLA)和腹侧海马(ventral hippocampus, vHipp)的谷氨酸能神经投射的轴突末梢均有表达,但光遗传学和化学遗传学选择性操控表明,只有PrL-NAc通路才是NAc核心部谷氨酸能神经传入中唯一同时介导焦虑和强迫症样行为的神经环路。抑制PrL-NAc谷氨酸能神经环路可预防急性束缚应激诱发的焦虑伴强迫症样行为,而组胺或H3受体选择性激动剂RAMH则可显著改善光激活PrL-NAc谷氨酸能神经环路诱导的焦虑伴强迫症样表型(图2)。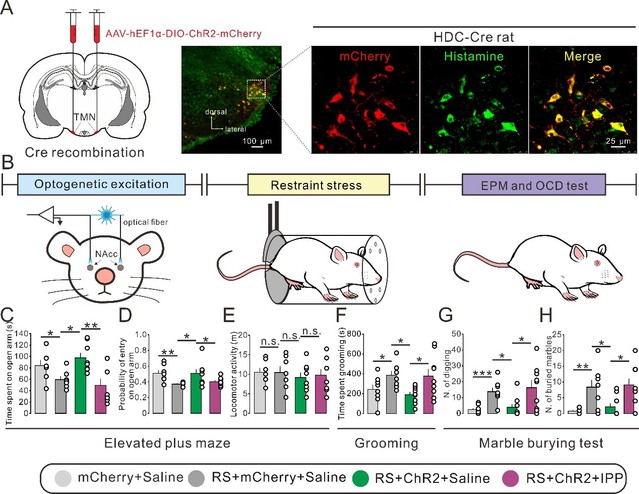
图1. 光遗传学选择性激活TMN-NAc组胺能神经投射改善由束缚应激诱导的大鼠焦虑样和强迫症样行为
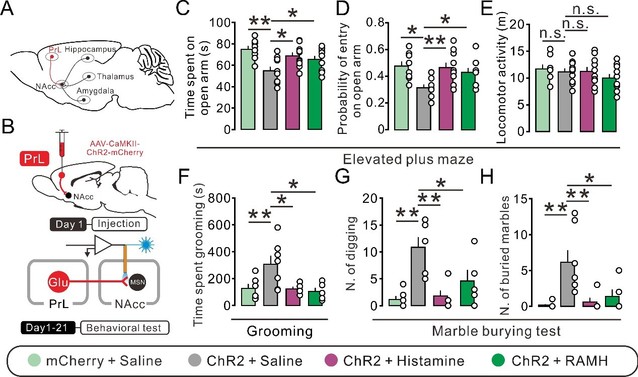
图2. 激活组胺H3受体改善由光遗传学选择性激活PrL-NAc谷氨酸能神经环路诱导的焦虑伴发强迫症样行为
该研究成果揭示了一条介导强迫症和焦虑症共病的PrL-NAc谷氨酸能神经环路,而该环路受到组胺H3突触前异身受体的调控。这一成果将为临床认识强迫症和焦虑症共病发生发展的病理生理机制、深部脑刺激NAc治疗难治性强迫症和焦虑症的神经机制以及靶向突触前H3受体潜在治疗策略的研发提供了全新的视角。
该项研究成果以“Targeting presynaptic H3 heteroreceptor in nucleus accumbens to improve anxiety and obsessive-compulsive-like behaviors”为题于2020年11月30日在PNAS上在线发表(https://www.pnas.org/content/early/2020/11/25/2008456117)。伟德BETVlCTOR1946副研究员张潇洋、博士后彭诗宇(现为上海交大医学院附属精卫中心助理研究员)、博士研究生沈丽萍和副研究员庄乾兴(现为南通大学医学院生理学系教授)为论文的共同第一作者,副研究员李斌(现为南京医科大学第一附属医院副研究员)为共同通讯作者,本科生史明润和马天宇参与了本项工作的研究。该工作受到国家自然科学基金和江苏省自然科学基金的资助。