肝纤维化是慢性肝病发展到肝硬化必经之阶段,是慢性病毒性肝炎及肥胖相关的脂肪肝病导致死亡的主要原因。迄今为止,对于肝纤维化仍缺少理想的治疗方法和治疗药物,究其原因,人们对于肝纤维化发生发展机理的认识不足,治疗肝纤维化缺少合适的切入点。针对这一难题,伟德BETVlCTOR1946医药生物技术国家重点实验室徐强课题组针对肝纤维化的关键细胞――肝星状细胞(HSC),发现了调控其活化和稳态的关键节点之一――CUGBP1-IFN-γ mRNA相互作用,并借助天然小分子化合物�酮,调控这个关键节点,从而实现通过激活内源性抗肝纤维化信号治疗肝纤维化的目的。题为“CUG-binding protein 1 regulates HSC activation and liver fibrogenesis”的重要成果最近在线发表在自然子刊Nature communications (DOI: 10.1038/NCOMMS13498)上。论文第一作者为吴兴新和吴旭东,通讯作者为徐强教授,吴旭东和吴雪丰为共通讯作者。
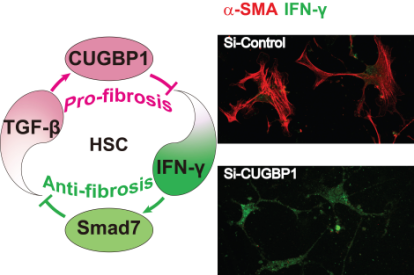
Fig. 1 HSC活化与稳态
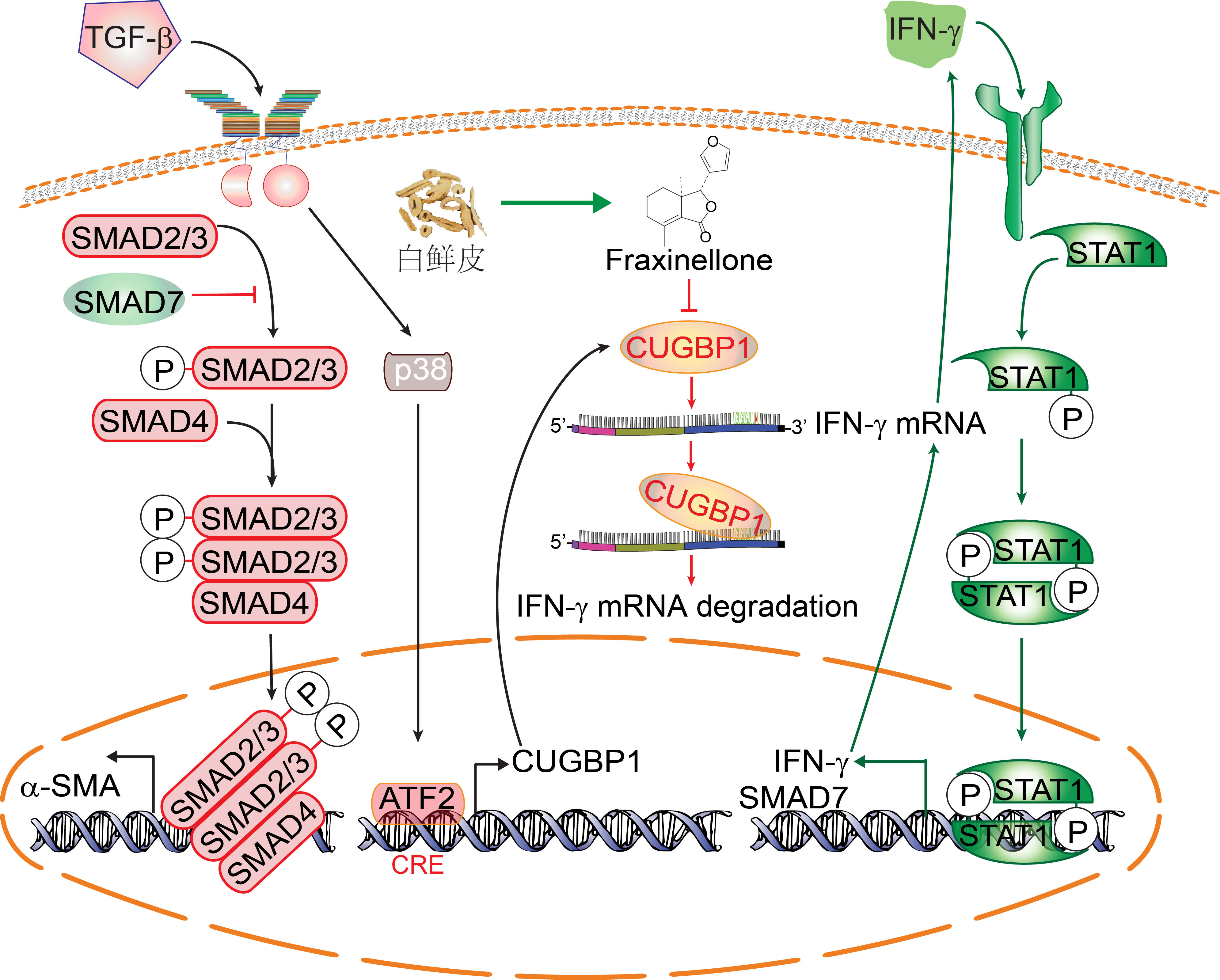
Fig. 2 HSC活化和稳态的关键节点及其小分子调控
HSC的活化是肝纤维化的中心环节,TGF-β信号是其活化的主要通路。现有抗肝纤维化疗法多以拮抗HSC为靶标,包括抑制其增殖、促进其凋亡以及阻断TGF-β信号等,但鲜有以其转归为调控目标的纤维化治疗。目前已知,多种信号参与调控HSC的活化,其中TGF-β是典型的促纤维化因子,直接诱导肝星状细胞活化、转化及分泌胶原,而IFN-γ信号则可通过直接抑制肝星状细胞的活化来发挥抗肝纤维化的作用。一般来说,TGF-β信号和IFN-γ信号的平衡有利于HSC维持稳态,使其进行可控性的适度活化(Fig. 1)。当发生肝纤维化时,促纤维化信号与抗纤维化信号处于失衡状态,HSC中促纤维化的TGF-β信号占主导,而抗纤维化的IFN-γ信号则很难检测到。
徐强课题组在研究中发现小分子化合物�酮可以抑制HSC的活化,特别令人感兴趣的是,�酮可诱导TGF-β活化的HSC表达内源性IFN-γ。进一步发现�酮可以降低RNA结合蛋白CUGBP1的表达。借助这一发现他们提出肝HSC活化的新假说:正常肝脏的HSC低表达CUGBP1,其IFN-γ信号不受抑制; HSC在活化启动阶段时,IFN-γ信号尚可控制细胞活化,使其恢复稳态;慢性肝病时HSC高表达CUGBP1,后者能抑制IFN-γ信号,进而使得TGF-β信号难以控制,导致HSC的持久活化,促进肝纤维化。这个新假说通过以下实验得到了证实:1、证明CUGBP1 表达与肝纤维化患者的纤维化阶段成正比。动物肝纤维化模型中证实,这种CUGBP1选择性地高表达于HSC中,而不在肝巨噬细胞、肝实质细胞和NK细胞等其他细胞中;2、TGF-β通过p38 MAPK途径促进HSC中 CUGBP1的表达 ;3、CUGBP1通过抑制IFN-γ表达及其信号转导促进 HSC 活化,其抑制IFN-γ系直接结合于IFN-γ mRNA的GRE序列从而使其降解;4、�酮通过下调HSC中CUGBP1表达并提高HSC中IFN-γ表达改善肝纤维化;5、在细胞和动物模型中敲低或过表达CUGBP1可选择性地调节HSC中IFN-γ的水平,从而影响HSC的活化或恢复稳态。
这项研究的主要创新点在于,发现了肝星状细胞中存在TGF-β-CUGBP1/IFN-γ-Smad7/TGF-β-α-SMA信号转导新环路,而CUGBP1及其与IFN-γ mRNA相互作用是联系HSC中TGF-β和IFN-γ这两条功能相反的信号通路、构成上述新环路的关键节点(Fig. 2),并借助小分子化合物�酮,实现了从新的切入点调控肝星状细胞活化和稳态,为肝纤维化的治疗提供了新策略。
全文链接如下:http://www.nature.com/articles/ncomms13498