
真菌二萜糖苷类产物粪壳菌素(sordarin),可以特异性抑制真菌蛋白质合成过程中延伸因子EF-2的活性,但对人体EF-2无作用,是一广泛研究的抗真菌候选药物。但sordarin结构上的复杂性使得化学全合成面临着高投入、低产出的难题;而全面解析sordarin的生物合成途径,可以为合成生物学法高效低廉的生产sordarin提供坚实的基础。
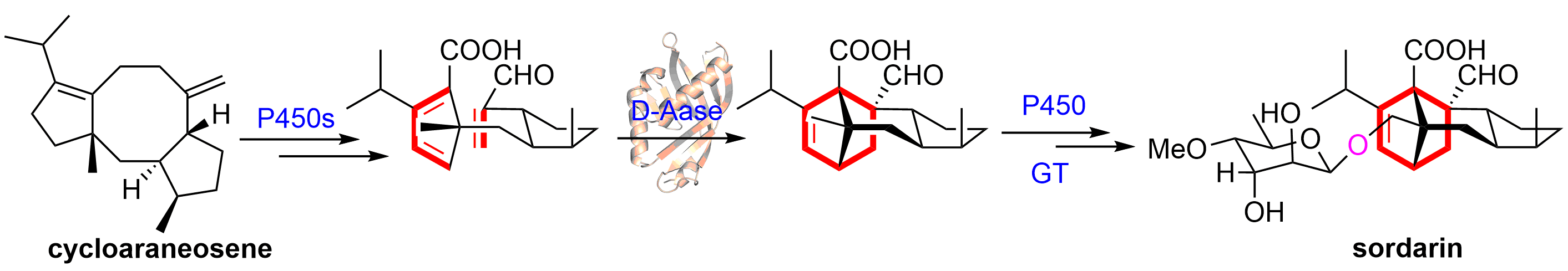
近期,伟德BETVlCTOR1946戈惠明教授、谭仁祥教授团队的研究完整阐明了从二萜cycloaraneosene到sordarin的生物合成途径,包括5/8/5环二萜骨架在多个P450的催化下形成关键的Diels-Alder(D-A)反应前体,再经一个新型D-A酶SdnG的催化形成了降冰片烯骨架,进一步的氧化和糖基化形成了最终产物,并通过对SdnG晶体结构的分析推测了该酶的催化机制。相关成果近期发表于Angew. Chem. Int. Ed.,并被编辑遴选为Hot Paper。
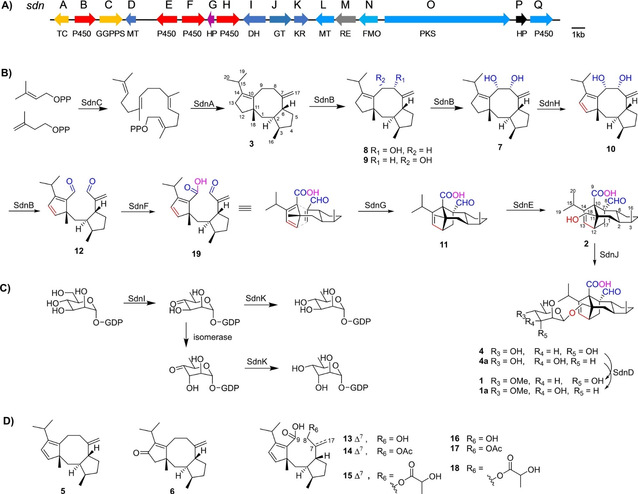
图1 Sordarin生物合成BGC、中间体及生物合成路径推测
通过对sordarin相关研究的前期调研和生物信息学工具在真菌Sordaria araneosa中确证了sordarin的生物合成基因簇BGC-sdn,通过体内的基因敲除、异源表达和代谢中间体结构的鉴定,证实了多个蛋白的功能(图1):其中,GGPP合酶SdnC与二萜环化酶SdnA负责了二萜骨架的形成;SdnK、SdnJ和SdnD负责了糖基单元的合成;4个P450氧化酶SdnB、SdnE、SdnF和SdnH在分子骨架的重排过程中发挥着重要的功能,SdnB催化了C8和C9位的连续羟基化形成7,并在后续的过程中再度负责了临二醇中C-C键的断裂,形成双醛基产物12;SdnH催化了7的一步去饱和反应,打造了D-A反应中的环戊二烯结构;SdnF负责将12中的C9醛基转化为羧基,加速了分子内D-A反应产物11的生成;SdnE负责催化一步羟基化以形成产物sordaricin。至此,sordarin的生物合成过程已然完整,但是同源基因簇对比发现了一个保守存在的基因sdnG, 该基因氨基酸序列中含有一个SnoaL_2结构域。从sdnG突变株中鉴定了6个与D-A反应底物类似的开环产物(13-18)(图1),这些现象都暗示了SdnG在分子内D-A反应中的潜在作用。
为了回答sordarin生物合成途径中是否包含了一个D-A酶,作者在体外纯化了SdnG的可溶性蛋白,并合成了化合物12和19,在体外进行了系列的酶反应实验。结果(图2)显示含双醛基的化合物12并不是SdnG的底物,而化合物19虽然可以缓慢自发地发生D-A反应,但在SdnG的催化下,可以快速且完全的催化19转化成降冰片烯产物11。从而,作者利用体外酶学实验回答了sordarin生物合成过程中分子内D-A反应是一步酶促反应过程。
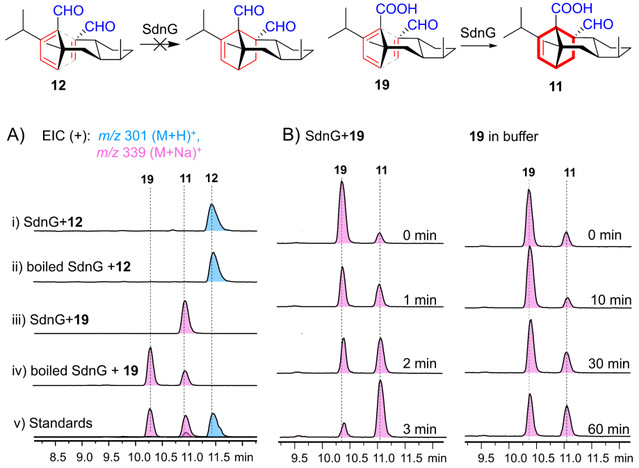
图2 D-A酶SdnG的体外功能表征
为了进一步了解SdnG的催化机制,获得了分辨率为2.70 Å的SdnG晶体结构(图3A)。基于结构的分析发现其三维结构与NgnD(图3B)类似,但是却塑造了处于不同位置的活性中心。随后产物11与SdnG晶体的分子对接的结果显示(图3G),化合物11主要被一些疏水残基包围,同时羧基部分与K127和H72通过盐桥相互作用,并与S91通过氢键相互作用,而醛基通过氢键被R129和Y41锁定,从而促进D-A反应的发生。随后通过点突变实验证明了这些氨基酸和SdnG的催化活性密切相关(图3H)。
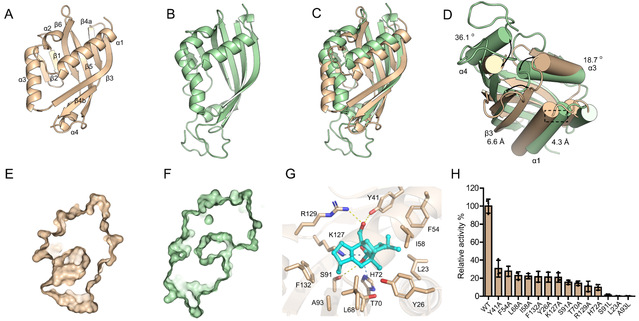
图3 SdnG和NgnD的晶体结构比较以及点突变
综上所述,该项工作通过体内基因敲除、中间体结构鉴定、生物转化、异源表达以及体外酶学实验完整的阐述了sordarin的生物合成的全过程,证明了4个P450氧化酶SdnB、SdnE、SdnF、SdnH在重排过程中发挥的重要功能,值得注意的是,前期课题组鉴定了一个新型D-A酶SdnG,负责催化降冰片烯骨架的生成,进一步扩展了自然界中酶促D-A反应的类别。这一工作,也将为抗真菌化合物sordarin的进一步组合生物合成研究和以微生物为底盘的工程化生产奠定了重大基础。
伟德BETVlCTOR1946的刘双鹤博士为文章的第一作者,伟德BETVlCTOR1946的戈惠明教授、谭仁祥教授和张博副教授为文章的通讯作者。该研究得到了国家重点研发计划、国家自然基金委杰出青年基金、青年基金及中央高校基本科研业务费等项目的资助。
原文链接:https://onlinelibrary.wiley.com/doi/10.1002/anie.202205577
文章题目:Biosynthesis of Sordarin Revealing a Diels-Alderase for the Formation of the Norbornene Skeleton